为保证我院临床试验管理有序化、规范化和研究资料的完整性,本机构结合实际情况,特制定此流程,请申办方/CRO参照本要求规定的具体流程进行操作。
一、提前终止的项目关中心流程
1.项目未启动
申办方/CRO递交试验项目终止函(附递交信)-PI-伦理/机构;
相关物资、试验用药品退还至申办方/CRO;
不进行机构质控。
2.项目启动未筛选
申办方/CRO递交项目终止函(附递交信)-PI-伦理/机构;
经费核对,按照《临床试验项目费用结算流程》执行;
相关物资、试验用药品退还至申办方/CRO;
不进行机构质控;
临床试验相关文件根据《药物临床试验质量管理规范》(2020年)要求进行保存,
如有特殊原因,申办方需出具说明。
3.项目筛选未入组
按照项目结题的关中心流程进行关中心;
不进行机构质控。
二、项目结题的关中心流程
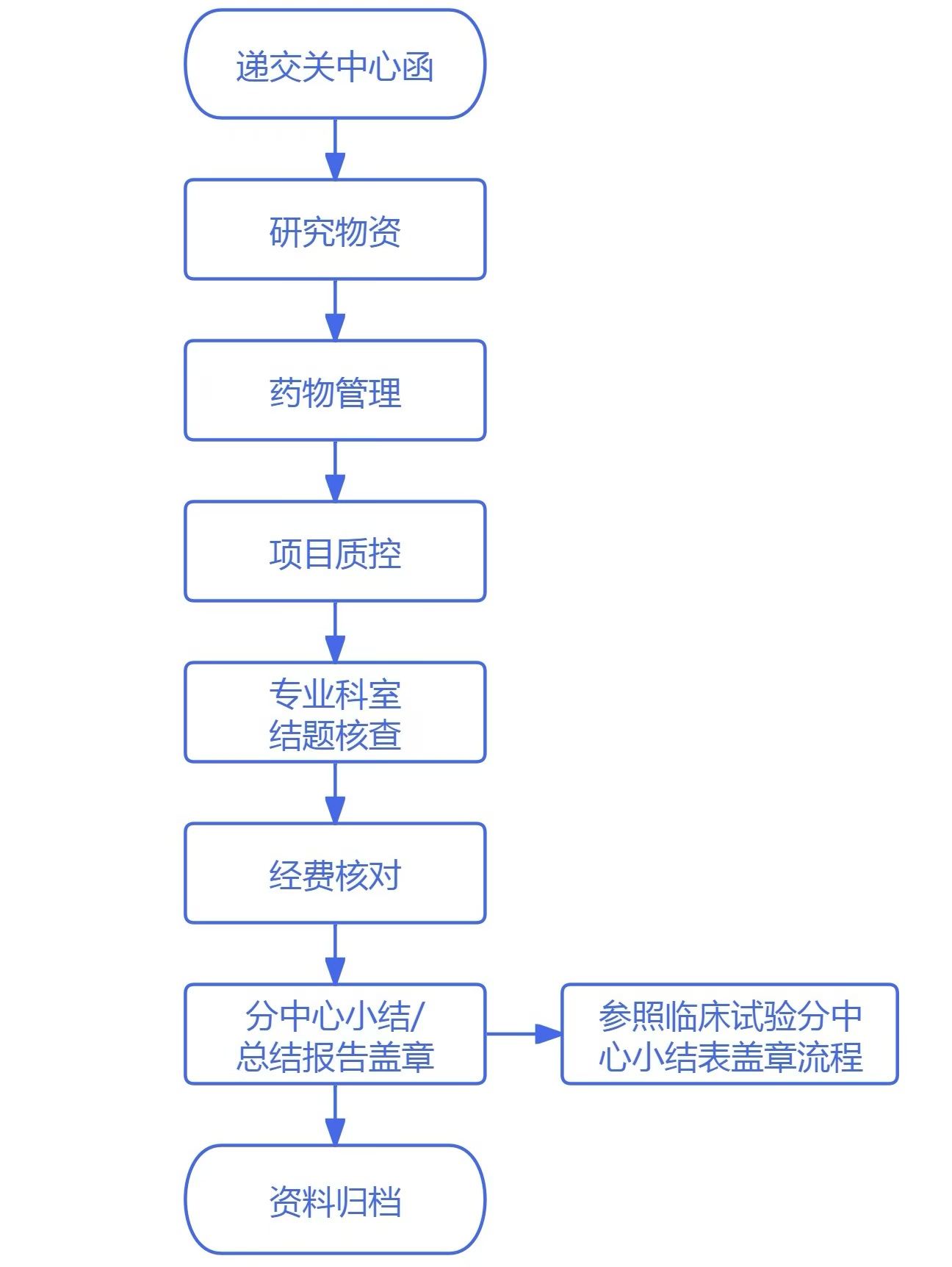
1.递交关中心函
申办方/CRO递交关中心函(附递交信),PI签字后递交。
2.研究物资
研究者/研究护士确认研究文件资料保存完整,研究物资已退回/处理,记录齐全,并在《临床试验结题签认表》(附件1)中签字;
3.药物管理
GCP中心药房药物管理员负责确认剩余试验药物已退回申办方或销毁,确认药物记录信息完整、资料齐全符合关中心要求,并在《临床试验结题签认表》中签字。
4.项目质控
专业科室质控:关中心前科室项目质控员对项目进行质控,并完成质控问题的整改,经研究者复核确认信息完整、资料齐全符合关中心要求,并在《临床试验结题签认表》中签字。
机构质控:机构完成该临床试验项目质控(首例、中期和结题),确认申办方/CRO/SMO对项目的监查、稽查结果反馈至机构;机构确认项目质控已完成,且质控问题已反馈整改,符合关中心要求后在《临床试验结题签认表》中签字。
5.专业科室结题核查
项目负责Sub-I完成专业科室《临床试验结题核查表》(附件2),经PI复核确认信息完整、资料齐全符合关中心要求,主要研究者与核查人共同签字确认。
6.经费核对
申办方按照《临床试验项目结题》材料要求整理,机构秘书核对并确认全部费用已结清,符合关中心要求后在《临床试验结题签认表》中签字。
7.分中心小结/总结报告盖章(参照临床试验分中心小结表盖章流程)
申办方向机构办公室递交《临床试验分中心小结表》进行审核,机构办公室审核完成后进行签章流程。可使用项目组模版或参考本中心《多中心临床试验分中心小结表》模版。(详见《分中心小结签章流程》要求)
8.资料归档
机构档案管理员对试验项目的归档资料进行审核,确认符合关中心要求后将所有试验相关资料进行整理归档(详见《临床试验资料归档》要求)。
项目结题的关中心流程